
草绿色链球菌关节假体周围感染
前言
美国全膝关节置换术(total knee arthroplasty,TKA)和全髋关节置换术(total hip arthroplasty,THA)手术量不断增加,伴随着并发症包括关节假体周围感染(periprosthetic joint infection,PJI)的数量也逐渐增加[1]。虽然全关节置换术(total joint arthroplasty,TJA)后PJI的发生率很低,报道的TKA和THA的PJI发生率分别为0.3%~1.7%和0.8%~1.9%,但尽管采取了干预措施,PJI的发生率仍在缓慢上升[2]。
引起PJI的微生物通常是细菌,它们可能来自于身体的其他部位,也可能来自手术伤口本身。例如,来自泌尿生殖系统、皮肤、胃肠道和口腔黏膜的微生物都被发现会引起PJI[3]。引起PJI的微生物来源的多样性侧面反映了其种类的多样性。目前的文献表明,金黄色葡萄球菌是最常见的感染源,其次是凝固酶阴性葡萄球菌、β-溶血性链球菌、肠球菌和草绿色链球菌[4]。然而,关于草绿色葡萄球菌引起的PJI的报道是有限的,在文献中也并不常见。此外,一项回顾性研究的结果表明,草绿色链球菌感染的发病率正在增加[2]。因此,本文旨在探讨草绿色链球菌PJI的预防、诊断和治疗。
草绿色链球菌(S.viridans)
草绿色链球菌是一组具有共同实验室特征的生物体。它们是革兰氏阳性球菌,呈链状形态。这些微生物不能在6.5%的NaCl或胆汁七叶树脂琼脂上生长。实验室检测结果表明,它们为过氧化氢酶阴性,吡咯烷酮基芳酰胺酶阴性,抗视黄素,不溶于胆汁。草绿色链球菌进一步分为五个亚种:变形链球菌、唾液链球菌、咽峡炎链球菌、血链球菌和缓症链球菌[5-7]。所有链球菌主要在口腔发现,而咽峡炎链球菌也可在胃肠道中发现[6]。
草绿色链球菌的每个亚种都有其鉴别特征,变形链球菌发酵甘露醇和山梨醇,水解七叶皂甙,Voges-Proskauer试验呈阳性;唾液链球菌VogesProskauer试验呈阳性,能水解七叶皂甙;咽峡炎链球菌能够水解精氨酸和七叶皂甙,Voges-Proskauer试验呈阳性;血链球菌能水解精氨酸和七叶皂甙;另一方面,缓症链霉菌不能水解精氨酸和七叶皂苷,不能发酵甘露醇和山梨醇,并且Voges-Proskauer反应阴性[5-7](表1)。
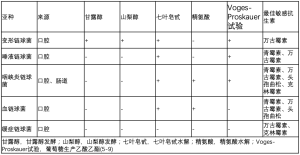
Full table
虽然相对罕见,也不常见于文献中,但几乎每个草绿色链球菌亚钟都能在原发性TKA或THA后引起PJI。研究人员描述了特定的亚种-变形链球菌[3,10],咽峡炎链球菌[11],血链球菌[12,13]或缓症链球菌[13-18]-或者引用为草绿色链球菌[3,18-31]作为他们患者的病原菌。在文献中未见明确报道唾液链球菌作为TKA或THA中PJI的病原菌。
预防
避免PJI后果的最好方法是在感染发生之前进行预防。虽然远距离来源被认为是PJI的罕见原因[32],但草绿色链球菌的特定亚种被认为是由于从身体的其他部位传播而导致PJI的。具体地说,通常在口腔中发现的变形链球菌[5,6,10]具有通过血液传播并感染关节假体的能力。关于人工关节患者口腔手术前预防性使用抗生素的文献颇具争议。在1997年之前,关于预防措施没有达成共识或专业性的建议。一些报告表明牙科手术与变形链球菌感染的发病有关[3,12,21,22,25]。这一发现催生了用抗生素减少侵入性口腔手术引起链球菌血源性传播的想法。
美国骨科医师学会(The American Academy of Orthopedic Surgeons, AAOS)和美国牙科协会(the American Dental Association, ADA)发布了三份关于TJA患者在口腔手术前使用抗生素预防的联合声明。此外,AAOS还就这一做法发布了进一步的个体声明[33-36]。第一份联合声明是在1997年发布的,该报告表明,大多数患者在牙科手术前并没有常规的抗生素预防措施。然而,某些人群患PJI的风险更高,应该考虑进行预防。这些患者包括正在接受血液传播感染高风险手术的患者,以及免疫功能低下的患者,或者在口腔手术后两年内接受TJA治疗的合并感染可能性很高的患者[34]。2003年,AAOS和ADA在综合文献分析的基础上发布了更新。主要的区别是根据术后两年的时间对建议进行了细化。抗生素预防仍被推荐用于高危牙科手术,但仅作为过去两年内接受TJA的患者的常规措施。在免疫功能低下和合并疾病的患者中,仍然只建议在进行高危牙科手术之前使用抗生素预防,但补充澄清的是,应不考虑TJA指数的持续时间[33,37]。此外,所有其他患者组均不建议使用抗生素预防:包括免疫低下或合并TJA患者的低风险牙科手术,或TJA手术后超过两年的患者[33,37]。
在1997年和2003年的声明中,高危牙科手术被定义为拔牙、牙周手术、牙种植体、超过牙尖的牙髓器械、龈下放置抗生素纤维或条带、放置正畸带、牙周内局部麻醉剂注射和预期出血的牙齿清洁。低风险手术包括修复性牙科、局部麻醉剂注射、根管内治疗、放置橡胶坝、术后拆线、放置可拆卸的修复体或正畸器具、取口腔印模、氟化物治疗、口腔X光片、正畸矫治器调整和乳牙脱落。高风险或低风险分层是根据细菌血源性传播的可能性进行的。如果患者有类风湿性关节炎、系统性红斑狼疮、其他炎症性多关节病,以及药物或放射诱导抑制的病史,则认为他们的免疫功能受损。并存的病症包括既往的PJI、营养不良、血友病、人类免疫缺陷病毒(HIV)、1型糖尿病或恶性肿瘤[33,34,37]。
AAOS在2009年发布了一份单独的信息声明,内容是关于有TJA病史的患者在口腔手术前进行抗生素预防的做法。AAOS建议所有患者在所有口腔手术前使用预防性抗生素,而不管手术后的时间或血源性传播的风险[37]。新的声明没有征询任何牙科专业组织的意见,最终未能成功取代2003年的合并报告[35]。
AAOS/ADA最新的联合推荐意见发布于2013年。该报告利用循证医学和文献综述来创建关于口腔牙科手术和PJI的建议。工作组总共提交了三项关于人工关节植入物患者口腔细菌传播与PJI关系的建议。第一项建议指出,卫生保健专业人员应考虑在侵入性牙科手术前停止使用抗生素预防。该建议评级为“有限的”,这意味着证据的质量并不令人信服,有力的研究也没有显示出任何一种做法有明显的优势。考虑到这一点,该论文强调,每个医疗服务提供者必须在考虑有限的建议、个人临床判断和患者的意愿后,决定什么是对患者最有利的。工作组得出的第二个结论是,他们无法建议或反对在关节假体植入物患者中使用局部口服抗生素。这一声明被评为“不确定”级,有人建议,医务人员应该意识到未来的研究成果会使这一争议问题被明确。获得一致支持的最后一项建议是,所有接受假肢关节植入物的患者都要保持适当的口腔卫生。共识是围绕小组成员的专家意见形成的,而不是基于公布的数据[36]。
当需要抗生素预防时,1997年和2003年的合并报告提供了建议的治疗方案,在口腔手术前一小时实施。一线抗生素治疗是口服2克阿莫西林、头孢拉定或头孢氨苄。如果患者不能耐受口服药物,那么可以静脉或肌肉注射1克头孢唑林或2克氨苄青霉素。如果患者对β-内酰胺类药物过敏,则建议口服或静脉注射600毫克克林霉素[34,37]。
诊断
研究表明,详细询问病史是确定感染源的最有效方法[38]。虽然来自血源性传播的远处感染被认为是PJI的罕见原因[32],但详细地询问病史将为临床医生提供完整的医学图像。
目前诊断PJI的标准出自2011年制定的肌肉骨骼感染协会(Musculoskeletal Infection Society,MSIS)标准(39项)。该标准定义了PJI为:存在与假体相通的窦道,或者病原体是两个单独的组织或液体样本中分离培养出来的。如果符合6项特定实验室措施中的4项,也可诊断为PJI:(I)血清血沉(ESR)和血清C-反应蛋白(CRP)升高;(II)滑液白细胞计数增加;(III)滑液中性粒细胞百分比升高;(IV)病变关节出现脓肿;(V)在一种组织或液体培养中分离出微生物;和/或(VI)在×400倍的5个高倍视野中,每高倍视野有5个以上的中性粒细胞。然而,该声明确实承认,PJI可能在不符合所列标准的情况下存在[39]。在MSIS标准之后,PJI国际共识小组制定了PJI的新定义,取消了脓肿的标准,并增加了白细胞酯酶作为感染的另一个指标[40]。
在采用标准化诊断标准之前,有多种诊断方法可以确定PJI的存在。具体地说,草绿色链球菌关节感染的诊断是基于多种因素。许多研究人员利用血清炎症标志物升高,特别是血沉和CRP作为感染的标志[13,14,16,18-20]。其他人则依靠关节液抽吸或术中组织标本的阳性培养结果[10,13,16,18,19,21,24,27,28]。为了提高诊断的敏感性,一些研究人员还将感染的临床照片[19,28]和放射学特征[19]纳入他们的评估中。然而,由于每项研究采用的方法略有不同,很难就提高草绿色链球菌感染诊断的可靠性达成共识。最近采用和实施的标准诊断标准将有助于今后对PJI的分析。
治疗
疑似或确诊PJI的治疗方案可以根据严重程度和症状持续时间的不同而有所不同。PJI治疗的金标准是两期切除关节成形术然后再植入[14,24,26,41,42]。然而,外科医生也可以选择单独使用抗生素抑制,清创并保留假体,或者更少见的,切除关节成形术,膝关节融合术或截肢[26,30,41]。由于治疗失败率和高发病率/死亡率的增加,这些次要选择已经不再受欢迎,只在特定情况下保留使用[41-45]。
虽然人们更倾向于等到病原菌被确定之后再开始抗生素治疗,但经验性覆盖是病情严重患者的一种选择。标准经验用药通常包括对葡萄球菌和革兰氏阴性杆菌的抗菌活性。然而,一旦草绿色链球菌的诊断得到确认,就必须改变治疗方法,并开始使用适当的抗菌药物。
草绿色链球菌的每个亚种对不同的抗生素表现出不同的最大敏感性。文献表明血链球菌对头孢曲松最敏感,缓症链球菌对克林霉素最敏感,咽峡炎链球菌对头孢曲松和克林霉素均敏感[8]。此外,所有的草绿色链球菌对万古霉素治疗都有很高的反应[8,9](表1)。正如许多生物体的情况一样,草绿色链球菌类生物,特别是缓症链球菌,对β-内酰胺类药物的耐药性已经表现出显著的增加[5,9,46]。
与其他微生物感染不同,链球菌PJI没有标准或推荐的治疗方案[11]。缺乏标准化可以解释为什么报道的治疗方法缺乏统一性。在接受二期关节置换术的患者中,聚甲基丙烯酸甲酯骨水泥中最常用的抗生素是万古霉素和妥布霉素,因为这两种抗生素都是热稳定的,万古霉素对草绿色链球菌有效,而妥布霉素与万古霉素有协同作用[47]。术后双重抗生素覆盖通常包括万古霉素和头孢他啶、利奈唑胺、妥布霉素、头孢噻肟或庆大霉素[14,18,19,23,28]。一位作者提出,与其他微生物相比,链球菌更容易受到初级抗生素的抑制[29]。或者,一些外科医生初期使用口服利福平和左氧氟沙星,然后改用阿莫西林进行长期抑制[15]。对于接受清创手术并保留假体的患者,抗生素覆盖可以应用萘福西林、青霉素和庆大霉素的三联疗法,或者青霉素和克林霉素的双重覆盖[27,30]。
结论
在美国,TJA的发病率预计会增加,与之相关的PJI的增加可能会导致更多的草绿色葡萄球菌感染病例。虽然绿色葡萄球菌是PJI的一个相对少见的病因,但目前关于绿色葡萄球菌PJI的文献很少,也缺乏全面的综述。其中四个亚种已被明确确定为PJI的病因:变形链球菌、咽峡炎链球菌、血链球菌和缓症链球菌。由于草绿色链球菌已知生活在口腔中,抗生素预防可以在侵入性牙科手术前使用,但仅限于给极有可能发生PJI的TJA患者。目前还没有针对链球菌或草绿色链球菌PJI的标准治疗方案,这可能是因为草绿色链球菌PJI的发病率较低。草绿色链球菌PJI的首选治疗方法与更常见生物的PJI相同,包括根据绿色葡萄球菌的每个亚家族使用不同的主要抗生素和进行两期切除关节成形术。
Acknowledgments
Funding: None.
Footnote
Conflicts of Interest: Both authors have completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/aoj.2017.06.10). AFC serves as an unpaid Associate Editor of Annals of Joint from Jun 2016 to May 2018. The other author has no conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Kurtz S, Ong K, Lau E, et al. Projections of primary and revision hip and knee arthroplasty in the United States from 2005-2030. J Bone Joint Surg Am 2007;89:780-5. [PubMed]
- Bjerke-Kroll BT, Christ AB, McLawhron AS, et al. Periprosthetic joint infections treated with two-stage revision over 14 years: An evolving microbiology profile. J Arthroplasty 2014;29:877-82. [PubMed]
- Waldman BJ, Mont MA, Hungerford DS. Total knee arthroplasty infections associated with dental procedures. Clin Orthop Relat Res 1997;164-72. [PubMed]
- Marculescu CE, Berbari EF, Cockerill FR, et al. Unusual aerobic and anaerobic bacteria associated with prosthetic joint infections. Clin Orthop Relat Res 2006;55-63. [Crossref] [PubMed]
- Doern CD, Burnham CD. It’s not easy being green: The viridans group Streptococci, with a focus on pediatric clinical manifestations. J Clin Microbiol 2010;48:3829-35. [PubMed]
- Coykendall AL. Classification and identification of the viridans streptococci. Clin Microbiol Rev 1989;2:315-28. [Crossref] [PubMed]
- Centers for disease control and prevention. Identification of Other Streptococcus Species: Streptococcus General Methods. Available online: https://www.cdc.gov/streplab/strep-doc/general-methods-section2.html
- Tuohy M, Washington JA. Antimicrobial susceptibility of ciridans group Streptococci. Diagn Microbiol Infect Dis 1997;29:277-80. [Crossref] [PubMed]
- Smith A, Jackson MS, Kennedy H. Antimicrobial susceptibility of viridan group streptococcal blood isolates to eight antimicrobial agents. Scand J Infect Dis 2004;36:259-63. [PubMed]
- Sonohata M, Kitajima M, Kawano S, et al. Acute hematogenous infection of revision total hip arthroplasty by oral bacteria in a patient without a history of dental procedures: case report. Open Orthop J 2014;8:56-9. [PubMed]
- Seng P, Vernier M, Gay A, et al. Clinical features and outcomes of bone and joint infections with streptococcal involvement: 5-year experience of interregional reference centres in the south of France. New Microbes New Infect 2016;12:8-17. [Crossref] [PubMed]
- Bartzokas CA, Johnson R, Jane M, et al. Relation between mouth and haematogenous infection in total joint replacements. BMJ 1994;309:506-8. [Crossref] [PubMed]
- Rasouli MR, Harandi AA, Adeli B, et al. Revision Total Knee Arthroplasty: Infection Should Be Ruled Out in All Cases. J Arthroplasty 2012;27:1239-43.e1-e2. [Crossref] [PubMed]
- Ben-Lulu O, Farno A, Gross AE, et al. A modified cement spacer technique for infected total hip arthroplasties with significant bone loss. J Arthroplasty 2012;27:613-9. [Crossref] [PubMed]
- Barba T, Wach J, Lustin S, et al. Metallosis-associated prosthetic joint infection. Med Mal Infect 2015;45:484-7. [Crossref] [PubMed]
- Parvizi J, Ghanem E, Menashe S, et al. Periprosthetic infection: What are the diagnostic challenges? J Bone Joint Surg Am 2006;88:138-47. [PubMed]
- Mortazavi SM, Schwartzenberger J, Austin MS, et al. Revision total knee arthroplasty infection: Incidence and predictors. Clin Orthop Relat Res 2010;468:2052-9. [Crossref] [PubMed]
- Hart WJ, Jones RS. Two-stage revision of infected total knee replacements using articulating cement spacers and short-term antibiotic therapy. J Bone Joint Surg Br 2006;88:1011-5. [PubMed]
- Joel J, Graham SM, Peckham-Cooper A, et al. Clinical results of linezolid in arthroplasty and trauma MRSA related infections. World J Orthop 2014;5:151-7. [Crossref] [PubMed]
- Buttaro MA, Tanoira I, Comba F, et al. Combing C-reactive protein and interleukin-6 may be useful to detect periprosthetic hip infection. Clin Orthop Relat Res 2010;468:3263-7. [PubMed]
- Grogan TJ, Dorey F, Rollins J, et al. Deep sepsis following total knee arthroplasty: Ten-year experience at the University of California at Los Angeles Medical Center. J Bone Joint Surg Am 1986;68:226-34. [Crossref] [PubMed]
- Lindqvist C, Slatis P. Dental bacteremia – a neglected cause of arthroplasty infections? Three hip cases. Acta Orthop Scand 1985;56:506-8. [Crossref] [PubMed]
- Swearingen MC, Granger JF, Sullivan A, et al. Elution of antibiotics from poly(methyl methacrylate) bone cement after extended implantation does not necessarily clear the infection despite susceptibility of the clinical isolates. Pathog Dis 2016;74:ftv103-4. [PubMed]
- Radoicić D, Popović Z, Barjaktarović R, et al. Infected total knee arthroplasty treatment outcome analysis. Vojnosanit Pregl 2012;69:504-9. [Crossref] [PubMed]
- LaPorte DM, Waldman BJ, Mont MA, et al. Infections associated with dental procedures in total hip arthroplasty. J Bone Joint Surg Br 1999;81:56-9. [Crossref] [PubMed]
- Hanssen AD, Trousdale RT, Osmon DR. Patient outcome with reinfection following reimplantation for the infected total knee arthroplasty. Clin Orthop Relat Res 1995;55-67. [PubMed]
- Jacobs MA, Hungerford DS, Krackow KA, et al. Revision of Septic Total Knee Arthroplasty. Clin Orthop Relat Res 1989;159-66. [PubMed]
- Darley ES, Bannister GC, Blom AW, et al. Role of early intravenous to oral antibiotic switch therapy in the management of prosthetic hip infection treated with one- or two-stage replacement. J Antimicrob Chemother 2011;66:2405-8. [Crossref] [PubMed]
- Everts RJ, Chambers ST, Murdoch DR, et al. Successful antimicrobial therapy and implant retention for streptococcal infection of prosthetic joints. ANZ J Surg 2004;74:210-4. [Crossref] [PubMed]
- Hyman JL, Salvati EA, Laurencin CT, et al. The arthroscopic drainage, irrigation, and debridement of late, acute total hip arthroplasty Infections: Average 6-year follow-up. J Arthroplasty 1999;14:903-10. [Crossref] [PubMed]
- Chen CE, Wang JW, Juhn RJ. Total hip arthroplasty for primary septic arthritis of the hip in adults. Int Orthop 2008;32:573-80. [Crossref] [PubMed]
- Uçkay I, Lübbeke A, Emonet S, et al. Low incidence of haematogenous seeding to total hip and knee prostheses in patients with remote infections. J Infect 2009;59:337-45. [Crossref] [PubMed]
- American Dental Association. Antibiotic prophylaxis for dental patients with total joint replacements. J Am Dent Assoc 2003;134:895-9. [Crossref] [PubMed]
- . Advisory statement. Antibiotic prophylaxis for dental patients with total joint replacements. American Dental Association; American Academy of Orthopaedic Surgeons. J Am Dent Assoc 1997;128:1004-8. [Crossref] [PubMed]
- Little JW, Jacobson JJ, Lockhart PB. The dental treatment of patients with joint replacements: A position paper from the American Academy of Oral Medicine. JADA 2010;141:667-71. [Crossref] [PubMed]
- Watters W, Rethman MP, Hanson NB, et al. Prevention of orthopedic implant infection in patients undergoing dental procedures. J Am Acad Orthop Surg 2013;21:180-9. [Crossref] [PubMed]
- Young H, Hirsh J, Hammerberg EM, et al. Dental disease and periprosthetic joint infection. J Bone Joint Surg Am 2014;96:162-8. [Crossref] [PubMed]
- Bouvet C, Tchernin D, Seirafi M, et al. No need to search for the source of haematogenous arthroplasty infections. Swiss Med Wkly 2011;141:w13306-5. [PubMed]
- Parvizi J, Zmistowski B, Berbari EF, et al. New definition for periprosthetic joint infection: from the workgroup of the Musculoskeletal Infection Society. Clin Orthop Relat Res 2011;469:2992-4. [Crossref] [PubMed]
- Parvizi J. Gehrke, International Consensus Group on Periprosthetic Joint Infection. Definition of periprosthetic joint infection. J Arthroplasty 2014;29:1331. [Crossref] [PubMed]
- Parvizi J, Zmistowski B, Adeli B. Periprosthetic joint infection: Treatment options. Orthopedics 2010;33:659. [PubMed]
- Cochran AR, Ong KL, Lau E, et al. Risk of reinfection after treatment of infected total knee arthroplasty. J Arthroplasty 2016;31:156-61. [Crossref] [PubMed]
- Brandt CM, Sistrunk WW, Duff MC, et al. Staphylococcus aureus prosthetic joint infection treated with debridement and prosthesis retention. Clin Infect Dis 1997;24:914-9. [Crossref] [PubMed]
- Crockarell JR, Hanssen AD, Osmon DR, et al. Treatment of infection with debridement and retention of the components following hip arthroplasty. J Bone Joint Surg Am 1998;80:1306-13. [PubMed]
- Klouche S, Lhotellier L, Mamoudy P. Infected total hip arthroplasty treated by an irrigation-debridement/component retention protocol: A prospective study in a 12-case series with minimum 2 years’ follow-up. Orthop Traumatol Surg Res 2011;97:134-8. [PubMed]
- Kennedy HF, Gemmel CG, Bagg J, et al. Antimicrobial susceptible of blood culture isolates of viridans streptococci: relationship to a change in empirical antibiotic therapy in febrile neturopenia. J Antimicrob Chemother 2001;47:693-6. [Crossref] [PubMed]
- Chen AF, Parvizi J. Antibiotic-loaded bone cement and periprosthetic joint infection. J Long Term Eff Med Implants 2014;24:89-97. [Crossref] [PubMed]
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Mathur A, Chen AF. Streptococcus viridans periprosthetic joint infections. Ann Joint 2017;2:36.



